Números de valencia o estados de oxidación.
La valencia es el número, positivo o negativo, que nos
indica el número de electrones que gana, pierde o comparte un átomo con otro
átomo o átomos.
El numero o estado de oxidación es la capacidad que tiene un
átomo de un elemento para combinarse con
los átomos de otros elementos y formar compuestos.
Reglas para determinar el numero de oxidación:
- El numero de oxidación de todos los elementos libres es cero.
- El estado de oxidación de hidrógeno (H) y sus componentes es +1.
- El numero de oxidación de oxigeno (O) en su compuesto es -2 (con pocas excepciones).
- La suma algebraica de los números de oxidación de los elemento de un compuesto dado es cero.
Aquí algunos ejemplos:
Para entender
mejor como saber el estado de oxidación
de un átomo te dejo el siguiente vídeo:
Números de valencia o estados de oxidación : Este tema de
química es realmente muy sencillo, simplemente hay que
aprenderse y tener en cuenta todas las reglas para saber el estado de oxidación de un átomo, si te das cuenta en las imágenes dadas anteriormente se cumplen todas las reglas dadas en este articulo el cual esta mostrado de manera fácil.
aprenderse y tener en cuenta todas las reglas para saber el estado de oxidación de un átomo, si te das cuenta en las imágenes dadas anteriormente se cumplen todas las reglas dadas en este articulo el cual esta mostrado de manera fácil.
Regla del octeto.
Los átomos constantemente pierden o comparten electrones tratando de alcanzar el mismo numero de electrones que los gases nobles.
Esta regla indica que cuando se van a enlazar átomos iguales, los electrones se organizan de tal manera que al forman un enlace se adopte una estructura rodeada de ocho electrones. En síntesis se refiere a los enlaces entre los elementos que están dados por electrones deben completar ocho electrones en su estructura.
Esta regla tiene algunos compuestos en la que no se aplican la formación de enlaces. Aquí unos ejemplos:
Si sumamos sus electrones no dan OCHO.
Ejemplos de reglas del octeto:
La regla del octeto: Esta regla se utiliza cuando los átomos pierden, ganan o comparten electrones; pues su suma debe dar ocho electrones. Hay algunos compuestos en los cuales no se cumple la regla del octeto y cabe aclara que estos compuestos son unas excepciones. En los enlaces se pueden formar un enlace sencillo o un enlace doble.
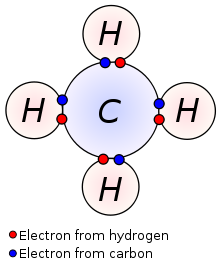
Estructuras de lewis.
La estructura de Lewis nuestra los pares de electrones de enlace dentro de los átomos de una molécula y los pares de electrones solitarios que pueden existir.
Las estructuras de lewis fueron propuestas del físico y químico Gilbert Newton Lewis; norteamericano al cual se le debe los estudios de los electrones periféricos de los átomos y el nombre de fotón a energía radiante.
Estas son estructuras mostradas de manera sencillas representando iones y compuestos que facilitan el recuento de los electrones.
Reglas de las estructuras de lewis:
1. Determinar la formula y determinar el átomo central y los átomos periféricos.
2. Determinar los electrones de valencia de la molécula.
3. Realizar los enlaces de el átomo central con los átomos periféricos.
4. Distribuir los electrones restantes como pares solitarios.
Ejemplos:
Aquí un vídeo con el que aprenderás a realizar las estructuras de Lewis:
Estructuras de lewis: Estas estructuras son las que representan los electrones de las moléculas, estos enlaces de la molécula fueron mostrados de manera sencilla por el químico y físico Robert N. Lewis con el fin de de tener el recuento exacto de los electrones de cada molécula. Con el articulo mostrado anteriormente se te sera sencillo aprender la estructura le Lewis.
Enlaces Químicos.
 Los enlaces químicos son las fuerzas que mantienen unidos o enlazados los átomos logrando que estas al momento de enlazarse compartan, reciban o pierdan electrones. Estos electrones denominados electrones de valencia determinan en que forma se unirán los átomos.
Los enlaces químicos son las fuerzas que mantienen unidos o enlazados los átomos logrando que estas al momento de enlazarse compartan, reciban o pierdan electrones. Estos electrones denominados electrones de valencia determinan en que forma se unirán los átomos.
Aquí en este vídeo esta la explicación para que puedas entender el enlace ionico:
Enlace covalente polar: Se produce cuando uno de los átomos tiene mayor fuerza de atracción de los electrones hacia su núcleo formando así una molécula positiva y una molécula negativa. Este tipo de enlace siempre se realiza entre dos átomos diferentes. Todo este concepto es definido mediante la electronegatividad.
Enlace covalente apolar: Se produce cuando los dos átomos tienen la misma fuerza de atracción de electrones hacia su núcleo. Este siempre se produce con átomos con la misma electronegatividad y con los mismos átomos.
Ejemplos:
Aquí un vídeo donde se explica de manera sencilla el enlace covalente y la manera de realizarse:
Enlaces Químicos.
 Los enlaces químicos son las fuerzas que mantienen unidos o enlazados los átomos logrando que estas al momento de enlazarse compartan, reciban o pierdan electrones. Estos electrones denominados electrones de valencia determinan en que forma se unirán los átomos.
Los enlaces químicos son las fuerzas que mantienen unidos o enlazados los átomos logrando que estas al momento de enlazarse compartan, reciban o pierdan electrones. Estos electrones denominados electrones de valencia determinan en que forma se unirán los átomos.
El enlaces es la interacción física en donde se interaccionan los átomos, iones o moléculas logrando una estabilidad en los compuestos diatómicos y poliatomicos. Todo esto con un fin, lograr la estabilidad tratando de parecerse al gas noble mas cercano, pero la mayoría de los electrones tratan de completar ocho electrones en su máximo nivel.
Los enlaces químicos se agrupan en tres distintos tipos de enlace químico para diferenciar las propiedades de cada compuesto.
- Enlace ionico.
- Enlace covalente.
- Enlace metalico.
Enlaces químicos: Los enlaces químicos son la unión de los átomos, en donde los átomos comparten, ganan o pierden electrones de tal manera que se pueda conseguir una estabilidad. Por lo general esto se llega a los ocho electrones en su máximo nivel y estos tratan de acercarse mas a un gas noble. Existen tres grupos de enlaces; el covalente, ionico y metálico.
Enlace ionico.
En enlace ionico es la fuerza de atracción eléctrica que une
dos átomos a través de una sección electrónica que existen entre los iones logrando mantener una estructura cristalina. Esta se da cuando un elemento electronegativo se une con en elemento electropositivo.
Al formarse estos iones de carga opuesta estos se atraen por fuerzas electrónicas intensas. Mientras sea mayor la electronegatividad entre los elementos mas fuerte sera el enlace ionico el cual se considera cuando la electronegatividad es superior a 1,7.
Ejemplos:
Aquí en este vídeo esta la explicación para que puedas entender el enlace ionico:
Enlace ionico: El enlace ionico es la fuerza de atracción de un elemento electropositivo con un elemento electronegativo logrando que estos dos compartan electrones, en donde uno pierde un electrón + y el otro gana un electrón -. La transferencia de estos electrones logra crear una estabilidad que por lo general llega a ocho electrones.
Enlace covalente.
El enlace covalente es la fuerza de unión de dos átomos mediante la compartición de un electrón por átomo de capa externa con el fin de formar una molécula estable. Aquí se pueden encontrar dos tipos de enlaces covalentes:
Enlace covalente polar: Se produce cuando uno de los átomos tiene mayor fuerza de atracción de los electrones hacia su núcleo formando así una molécula positiva y una molécula negativa. Este tipo de enlace siempre se realiza entre dos átomos diferentes. Todo este concepto es definido mediante la electronegatividad.
Enlace covalente apolar: Se produce cuando los dos átomos tienen la misma fuerza de atracción de electrones hacia su núcleo. Este siempre se produce con átomos con la misma electronegatividad y con los mismos átomos.
Ejemplos:
Aquí un vídeo donde se explica de manera sencilla el enlace covalente y la manera de realizarse:
Enlace covalente: Es donde una fuerza unen dos átomos mediante la compartición de un electrón por átomo, existen dos tipos de enlaces covalentes, el apolar; en donde los átomos tienen diferencia de electronegatividad y también esta en polar; En donde los átomos son iguales de electronegatividad.
Enlace metálico.
Este enlace como su nombre lo indica es la unión de dos átomos de metales, este enlace es fuerte y sucede entre elementos de la misma especie. En este enlace los átomos pierden electrones externos logrando formar una nube electrónica.
Los metales pueden ser fácilmente encontrarlos en la naturaleza , algunos metales como el Sodio se pueden encontrase en el océano donde se encuentras disueltos o otros metales se pueden encontrar en depósitos minerales.
El metal forma parte de compuestos químicos, estos presentan propiedades que los diferencian como ; ser conductores de calor y de electricidad. Estos tienen la ventaja de ser deformables permitiendo que esta sirva de manera industrial.
Los metales suelen presentarse como sólidos de dureza variable y con muchos puntos de ebullición.
Ejemplos:
Aquí un vídeo donde te explicaran mejor sobre el enlace metálico:
Enlace metálico: El enlace metálico es la unión de átomos metálicos en donde los metales de estado solido forman un cristalino tridimensional los cuales lograr que se muevan libremente los electrones de valencia, el metal tiene bastantes usos y ademas estos se pueden encontrar en las naturales.


















No hay comentarios:
Publicar un comentario